Вопрос о том, существуют ли специфические изменения кариотипа в клетках опухолей, привлек особое внимание после того, как было обнаружено постоянное изменение одной из малых хромосом (группы G) при хроническом миелоидном лейкозе человека.
Изучение с этой точки зрения опухолей, вызванных у лабораторных животных (мышей, крыс, сирийских хомяков, китайского хомячка) химическими канцерогенами и вирусами, пока не дало доказательств существования специфических хромосомных нарушений (Nowell, 1965; Nachtigal и др., 1967; Kato и др., 1964).
Число изученных опухолей относительно невелико и исследования в этом направлении на разных животных с применением различных канцерогенных агентов должны продолжаться.
После опубликования доклада Данверской группы кариотип опухолей человека стали анализировать более подробно, чем раньше, определяя наличие изменений в каждой хромосомной группе и выделяя при построении идиограмм маркерные хромосомы.
Следует подчеркнуть, что в методическом отношении плотные опухоли человека являются наиболее трудным для цитогенетического исследования материалом (трудности приготовления клеточной суспензии из плотных опухолей, отсутствие митозов на препарате, плохое расхождение хромосом и т. п.). Поэтому при прямом анализе процент пригодных для него случаев не превышает, по данным разных авторов, 5—15 от общего числа случаев, полученных из операционных. Хорошо описали причины отсева получаемого материала Atkin и Baker (1966). От предварительного культивирования материала опухолей человека большинство цитогенетиков теперь отказались, так как даже в случае хорошего роста культуры (что наблюдается далеко не при всех опухолях) никогда нет уверенности в том, что в митоз вступают собственно опухолевые клетки, а не нормальные элементы соединительнотканной стромы.
В силу перечисленных причин накопление сведений о состоянии кариотипа при опухолях человека шло гораздо медленнее, чем изучение цитогенетики лейкозов. Все же к настоящему времени собран довольно значительный материал по изменчивости числа хромосом, охватывающий, вероятно, уже около 300 случаев опухолей разных локализаций, изученных на материале как выпотов (асцитная и плевральная жидкости), так и плотных опухолей.
Опухоли человека, характеризующихся нормальным диплоидным кариотипом, вообще не обнаружено. В материале выпотов процент околотетраплоидных опухолей выше, чем в плотных (первичных) опухолях. Это, вероятно, связано с тем, что опухолевые выпоты образуются в поздних стадиях развития процесса, когда «удельный вес» вторичной хромосомной изменчивости возрастает. Никакой связи между общим числом хромосом и типом опухоли (локализация, гистологическое строение, клиническое течение) установить не удалось. Одинаковые опухоли могут обладать разным числом хромосом и относиться как к диплоидной, так и к триплоидной или тетраплоидной группе (Makino и др., 1959; Miles, 1967а, b; Hauschka, 1963; Sandberg и др., 1967; Yamada и др., 1966).
Подробный кариограммный анализ, охватывающий, конечно, гораздо меньшее число случаев, чем числовой анализ, также показал отсутствие закономерной связи между характером и степенью изменения кариотипа и типом опухоли (Makino и др., 1964; Sandberg, 1966; Sandberg и др., 1966; Yamada и др., 1967).
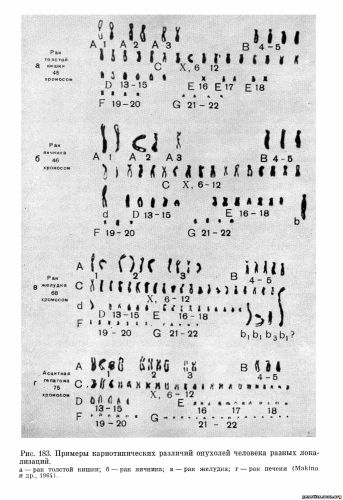
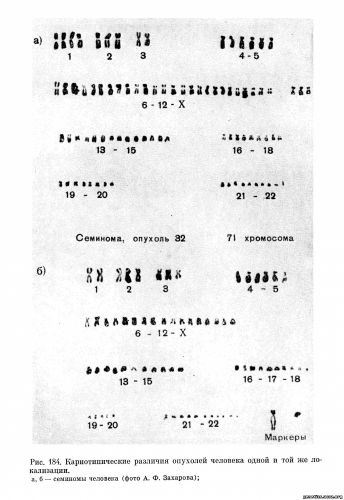
На рис. 183—184 приведены примеры идиограмм стволовых клеток некоторых опухолей человека, демонстрирующие отличия как по числу хромосом в отдельных группах, так и по числу и типу хромосом-маркеров.
Таким образом, подавляющее большинство цитогенетических исследований пока не дало доказательств существования специфических изменений кариотипа при опухолях. Значит ли это, что данный вопрос уже решен отрицательно? Нет, отнюдь не значит. Не говоря уже о том, что в последние годы появился ряд интересных сообщений, если не доказывающих, то во всяком случае говорящих в пользу специфического изменения хромосомных наборов в клетках некоторых новообразований, поиски таких изменений при уже исследованных опухолях надо продолжать.
Если первичное специфическое изменение кариотипа мало и касается какой-либо хромосомы, не идентифицируемой индивидуально, например хромосомы группы 6—12—X, то такое изменение вообще трудно обнаружить. На фоне же вторичной изменчивости, возникающей в процессе роста опухоли, незначительное первичное изменение может просто остаться незамеченным. Вспомним, что делецию малой хромосомы группы G при хроническом миелоидном лейкозе, распознаваемую теперь без особого труда, сначала даже опытные цитогенетики просто не замечали. Чтобы обнаружить незначительное специфическое изменение на фоне нередко сложных вторичных изменений, необходимо, во-первых, накопление большего числа детально проанализированных случаев как разных опухолей, так и опухолей одного и того же типа и, во-вторых, разработка новых методических приемов, которые позволили бы получать достаточное количество делящихся клеток, относящихся к возможно более ранним стадиям опухолевого процесса. Кроме того, желательно располагать для цитогенетического анализа опухолями животных, обладающих сравнительно простым кариотипом, таким, например, как у австралийской сумчатой мыши (Marsin, Hayman, 1967) или у джунгарского хомячка (Е. Е. Погосянц и Э. Г. Бруяко, 1967). Все эти пожелания со временем будут, конечно, выполнены, а до тех пор следует воздержаться от заключения, что при опухолях специфического изменения кариотипа вообще не существует.
Обратимся теперь к упомянутым выше новым работам, где сообщается об интересных цитогенетических находках, в какой-то мере говорящих в пользу неслучайного характера хромосомных нарушений при некоторых опухолях.
Прежде всего отметим появившиеся одновременно, но независимо друг от друга сообщения двух авторов (Levan, 1966; Steenis, 1966), проанализировавших данные литературы о кариотипе опухолей человека с точки зрения изменчивости числа хромосом по отдельным группам Денверской классификации. После соответствующей статистической обработки материала эти авторы пришли к одинаковому заключению, что изменение числа хромосом разных групп в кариотипе опухолей носит неслучайный характер. Так, по данным Levan, число хромосом в группе С в большинстве проанализированных случаев (в 27 из 40) оказалось увеличенным против нормы, тогда как в группах D и G оно оказалось (в соответственно 34 и 33 опухолях из 40) уменьшенным против нормы. Сходные данные на меньшем материале получены и в другой работе. Не исключено, как отмечает Steenis, что эти изменения являются результатом склонности к поломкам и транслокациям акроцентрических хромосом групп D и G, в результате чего образуется дополнительное число хромосом, неотличимых от двуплечих хромосом группы С. Являются ли изменения специфической и первичной чертой всех опухолей, или же это вторичный признак, отражающий единое направление изменений кариотипа в ходе опухолевого прогресса, сказать пока нельзя опять-таки потому, что ранние стадии малигнизации цитогенетически изучены очень слабо и что соответствующий анализ проведен пока в отношении сравнительно небольшого (40 случаев) числа опухолей. В последние годы появились работы, в которых описывается одинаковое изменение хромосомного набора клеток разных опухолей, относящихся к одному виду новообразований.
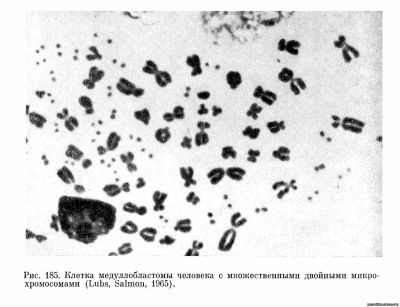
В одном случае речь идет об опухолях головного мозга — медуллобластомах человека (Сох и др., 1965; Lubs Salmon, 1965). В 2 из 6 исследованных случаев в этих опухолях обнаружены двойные хромосомные тельца или фрагменты (рис. 185), число которых колебалось от 1 до 32 на клетку. Эти две опухоли описаны в разных странах (США и Англии), что свидетельствует о независимом изменении кариотипа в этих случаях. В одной из работ (Lubs, Salmon, 1965) сообщается, что опухолевые клетки с двойными фрагментами были обнаружены у больного ребенка в крови и костном мозгу. Этот факт представляет большой интерес для диагностики данной опухоли. Цитированные работы вызвали большой интерес, так как казалось, что они указывали на наличие специфического изменения кариотипа в опухоли. Однако недавно появилось сообщение Mark (1967) о том, что в некоторых саркомах мыши, вызванных вирусом Рауса, также обнаружены двойные хромосомные тельца, очень напоминающие тельца, описанные в клетках медуллобластом. Возможно, что эти изменения связаны с присутствием в опухоли вируса (в одном случае вируса Рауса, а в другом — еще неизвестного вируса).
Более интересное наблюдение касается другой опухоли головного мозга (Zang, Singer, 1967). В первичных культурах клеток, полученных в 8 разных случаях менингиомы, обнаружено аналогичное изменение кариотипа: утрата одной из хромосом группы G. Общее число хромосом в разных опухолях колебалось от 42 до 46 за счет добавления или утраты одной из хромосом С, D или Е. Но при этом всегда отсутствовала одна из хромосом G. Было бы интересно выяснить, подтвердятся ли эти данные в других случаях аналогичных опухолей и не в культурах, а при прямом анализе клеток менингиом.
К обсуждаемому вопросу имеют отношение и работы по кариологии так называемой венерической саркомы собак. Это новообразование (подозреваемой, но пока не доказанной вирусной природы) передается от животного животному с помощью клеток при случке (А. Карльсон и Ф. Манн, 1953).
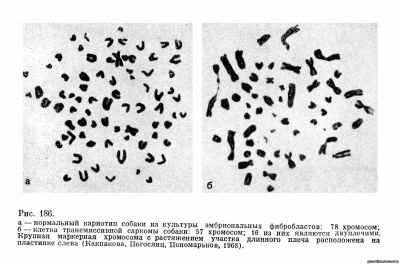
При изучении хромосом в этой опухоли (Takayama, Makino, 1961) было обнаружено резкое и сложное изменение кариотипа, одинаковое для 6 изученных случаев. Вместо 78 хромосом, характеризующих нормальный кариотип собак, в опухолевых клетках наблюдалось уменьшение общего числа хромосом (до 56—59) и появление большого числа (свыше 12) двуплечих хромосом (в норме у собак только Х-хромосомы двуплечие); кроме того, имелась крупная маркерная хромосома со вторичной перетяжкой.
Аналогичные изменения были затем описаны для более чем десятка других опухолей, полученных от собак, происходящих из разных районов Японии (Makino, 1963). Поскольку венерическая саркома передается от собаки собаке при случке, естественно было предположить, что одинаковое изменение кариотипа не возникает заново, а связано с распространением опухоли за счет переноса живых опухолевых клеток. Однако в дальнейшем появились работы, в которых описывается аналогичное изменение кариотипа в двух исследованных опухолях у собак в США (Weber и др., 1965) и в 3 опухолях у собак во Франции (Barski и др., 1966). В 1966 г. мы совместно с Е. С. Какпаковой и В. Н. Пономарковым начали изучать кариотип венерической саркомы у собак, поступающих с этим заболеванием в зоо-онклинику нашего института . Материал, включающий анализ 213 клеток 4 опухолей, полностью совпал с данными других авторов. Модальное число хромосом снижено против нормы до 57—59, а число двуплечих хромосом (включая Х-хромосомы) достигает 12—19. Присутствуют две характерные маркерные хромосомы (рис. 186). Вероятно, транслокации акроцентриков или центромерные слияния хромосом лежат в основе наблюдаемых изменений.
Ввиду того что сходное изменение хромосомного набора в клетках венерической саркомы собак обнаружено теперь в 4 странах трех континентов, предположение о независимом и первичном изменении кариотипа в клетках разных опухолей становится более вероятным. В то же время сложный характер изменения и множественность хромосомных перестроек не позволяют окончательно принять такое предположение.
В качестве альтернативного объяснения приходится думать о происхождении всех опухолей этого типа от одной исходной опухоли путем переноса живых опухолевых клеток. Это означает, что особенности кариотипа венерической саркомы собак сохранились на протяжении десятков, а скорее сотен лет, в течение которых происходило расселение разных пород собак по разным странам и континентам. Как бы ни был решен этот вопрос в дальнейшем, очевидно, что описываемое изменение кариотипа является адаптивным для опухолевых клеток, так как оно сохраняется отбором либо на протяжении роста каждой независимо возникшей опухоли, либо на протяжении многих тысяч лет клеточных генераций при естественных перевивках исходной опухоли.
Наконец, обсуждая вопрос о специфическом изменении кариотипа опухолей, нельзя не коснуться значения случаев обнаружения у человека в разных опухолях одной локализации сходных маркерных хромосом.
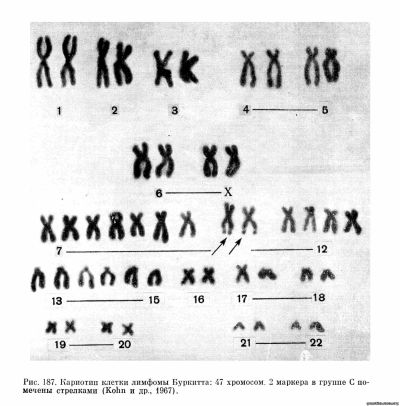
В последние годы появился ряд сообщений, где разными авторами описаны сходные по виду маркерные хромосомы в нескольких опухолях яичка человека (Galton и др., 1966; Martineau, 1966; Fischer, Golob, 1967) и в клетках первичных и культивируемых лимфом Буркитта (Jacobs и др., 1963; Stewart и др., 1965; Kohn и др., 1967; Miles, O’Neill, 1967). Ряд авторов, изучавших хромосомы в клетках лимфомы (Kohn и др., 1967), наблюдали в дистальной части длинного плеча маркерной хромосомы, которую они расценивают как производную хромосомы 10, характерную вторичную перетяжку (рис. 187). Это изменение кариотипа, наблюдавшееся в 4 из 5 исследованных линий, авторы расценивали как специфическое. Однако поскольку в этой работе исследовали материал не первичных опухолей, а культивируемых линий, несущих, как указывают сами авторы, герпесоподобный вирус, и поскольку в других работах, посвященных хромосомному анализу лимфомы Буркитта, описываются другие маркеры, причем не всегда одинаковые, считать приведенные данные убедительным доказательством специфичности изменения кариотипа при этом новообразовании пока нельзя.
Следует отметить, что вопрос об идентичности сходных по виду маркерных хромосом решается совсем не просто. Хромосомы одинаковой величины и формы могут возникнуть в кариотипе клеток человека за счет различных аберраций (транслокаций, делеций, перицентрических инверсий) разных хромосом.
До появления методических возможностей индивидуальной идентификации хромосом и отдельных плеч хромосом в кариотипе человека судить о генетической идентичности маркеров большей частью невозможно. Поэтому заключения о специфичности изменения кариотипа опухолей лишь по внешнему сходству маркерных хромосом могут оказаться неверными.
Хотя сам феномен изменчивости хромосомных наборов опухолевых клеток изучен уже на большом числе опухолей, роль анэуплоидии и структурных нарушений хромосом при возникновении рака и других злокачественных новообразований остается спорной. В настоящее время большинство авторов склонно считать, что малигнизации может идти разными путями и быть связана как с мутационными изменениями на генном и хромосомном уровнях, так и, возможно, с функциональными нарушениями генетического аппарата клетки. Обсуждая этот вопрос, Sandberg (1966) приводит схему, изображающую три возможных пути возникновения опухолей: А) в результате генных мутаций; В) путем изменения генов, приводящего к хромосомным мутациям, а затем к малигнизации; С) прямо в результате хромосомных нарушений. По-видимому, примером последней возможности является хронический миелоидный лейкоз человека, возникновение которого связано со специфическим нарушением кариотипа — делецией хромосомы 21 или 22.
Вторичные изменения кариотипа, возникающие в процессе роста опухолей, не будучи прямо связаны с процессом малигнизации, имеют тем не менее несомненное биологическое значение, обеспечивая генетическую гетерогенность популяций опухолевых клеток и возможность отбора наиболее приспособленных к данным условиям среды клеточных вариантов. Способность опухолевых клеток к мутационным изменениям на генном и хромосомном уровнях, а также селективное размножение клеточных вариантов лежат в основе важного в теоретическом и клиническом аспектах явления опухолевой прогрессии.
В настоящее время в круг цитогенетических исследований в онкологии все больше входят разнообразные опухоли человека. По мере усовершенствования методик анализа хромосом человека цитогенетика рака, несомненно, обогатится новыми важными открытиями.