Как отмечает И. А. Рапопорт (1965), идея о химических веществах как агентах, повышающих частоту мутаций, возникла еще в начале прошлого столетия, и к моменту появления первых работ (В. В. Сахаров, 1932; М. Лобашов и Ф. Смирнов, 1934) было опубликовано уже около сотни исследований, посвященных этому вопросу. По мере развития учения о химическом мутагенезе сложилось представление, что химические вещества наряду с ионизирующей радиацией могут быть важным фактором мутационного процесса и у человека. Однако это представление основано почти исключительно на экстраполяциях. Необходимо отметить, что если мутагенный эффект химических веществ четко демонстрируется в экспериментах на вирусах, бактериях, насекомых и растениях, то прямых доказательств в отношении человека не имеется. Единственное, чем мы располагаем, это фактами, из которых следует, что некоторые химические агенты вызывают повреждения хромосом человека как при введении этих веществ в организм с лечебными или диагностическими целями, так и при обработке ими клеток человека, культивируемых in vitro. В отношении человека пока еще нет никаких данных о повышении частоты генных мутаций при воздействии химических веществ. Это связано с трудностями генетического анализа у человека, трудностями реальными, но, по-видимому, преодолимыми. Можно указать хотя бы на возможность применения учета частоты хромосомных аномалий или доминантных мутаций (типа ретинобластомы) в потомстве лиц, подвергавшихся воздействию тех или иных химических агентов. Такой подход рекомендован В. П. Эфроимсоном (1964) для учета генетического эффекта радиации. Следствием отмеченной трудности является своеобразная черта всех исследований по индуцированному мутационному процессу у человека: в подавляющем большинстве случаев исследуются хромосомные аберрации в соматических клетках человека, и речь идет по существу о мутационном процессе в соматических клетках, что относится к проблемам генетики соматических клеток. В связи с этим часто высказывается справедливое мнение, что информация, полученная при исследовании соматических клеток в случае изучения аберраций в популяциях митотически размножающихся клеток, не может ничего дать для понимания того, что происходит в мейозе, т. е. в герминативных клетках. Несмотря на правильность такого рода соображений, следует все-таки помнить, что мейозу предшествует митоз, и мы еще точно не знаем судьбы аберрантных гониальных клеток. Кроме того, познание закономерностей мутационного процесса в популяциях соматических клеток важно само по себе, если иметь в виду проблемы канцерогенеза, тератогенеза и хромосомного мозаицизма. Следует также упомянуть о том, что существует возможность, правда трудно реализуемая, изучения мутагенного эффекта, точнее повреждающего действия химических агентов, на хромосомы человека в мейозе. Наиболее реальным в этом отношении представляется изучение хромосомных аберраций в клетках семенников, удаляемых у больных с опухолью предстательной железы, которые, как правило, лечатся различными противораковыми химическими препаратами.
Мы коснемся лишь тех исследований по вопросу влияния химических соединений на хромосомы, которые сделаны на людях, т. е. речь будет идти о мутагенном эффекте лекарственных препаратов. Одной из первых работ, в которой было обращено серьезное внимание на то, что лекарственные препараты могут быть мутагенами, можно считать обзор Barthelmess (1956), который так и называется — «Мутагенные лекарства». Однако этот автор смог сообщить только об обнаружении мутагенного эффекта лекарственных препаратов при воздействии на удобные тест-объекты — дрозофилу и некоторые растения. Только в 1961 г. появилось в печати наблюдение Сопеп и Lansky, которые сообщили, что в культуре лейкоцитов периферической крови больного бронхогенным раком легких, лечившегося препаратами азотистого иприта, на 6-й день после начала лечения хромосомных аберраций обнаружено не было. Авторы полагают, что указанный препарат может достигать половых клеток. В 1962 г. Arrighi, Hsu и Bergsagel (1962) отмечают, что у 4 больных, лечившихся цитоксаном (21-био-2-хлорэтиламино-1-1,3,2-оксазофосфоридин-2-оксид) по поводу ретикулоклеточной саркомы, в клетках культуры лейкоцитов периферической крови были обнаружены хромосомные аберрации, среди которых были дицентрические хромосомы, ацентрические фрагменты, хроматидные разрывы, микрохромосомы и новые, необычные хромосомы, появившиеся вследствие сложных перестроек. Число аберраций в пересчете на клетку было от 1,56 у одного больного до 0,17; 0,20 и 0,24 — у других. В контроле (культуры до лечения) аберраций обнаружено не было.
Nasjleti и Spencer (1966) установили, что у больных, леченных азотистым ипритом, во время лечения не только резко возрастает количество аберраций хромосом, но и увеличивается частота полиплоидных клеток (с эндоредуплицированными и случайно разбросанными хромосомами). Эти же авторы показали, что клетки с поврежденными хромосомами быстро исчезают из крови после окончания лечения. Кроме того, Nasjleti и Spencer продемонстрировали, что при воздействии этих веществ на клетки здоровых людей в культуре появляются такие же аберрации, примерно в таком же количестве, и имеется линейная зависимость эффекта от дозы.
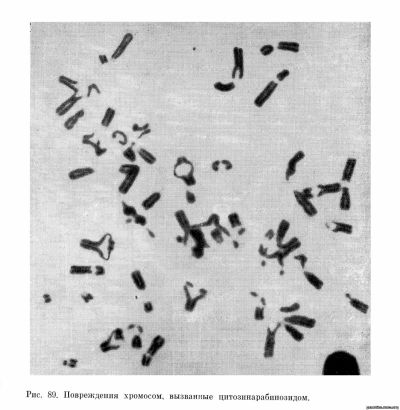
В последнее время опубликованы работы, в которых сообщается о мутагенном эффекте аналогов оснований и ингибиторов синтеза нуклеиновых: кислот. Bell, Whang, Carbone, Brecher, Block (1966), а также Block, Bell,, Whang и Carbone (1965) исследовали аномалии хромосом и гематологические показатели у больных миелолейкозом и солидными опухолями, леченных ингибитором синтеза ДНК цитозинарабинозидом. Этот препарат назначался больным в дозе 100—200 мг на 1 м2 поверхности тела ежедневна в течение 5 дней. Гематологические и цитогенетические изменения можно было отметить в клетках пунктата костного мозга уже спустя 24 часа после введения препарата, и они достигали максимума на 5-й день лечения. Цитогенетический эффект препаратов был весьма сильным и намного превосходил эффект других цитостатических средств — около 85—95% клеток имели повреждения хромосом. Наблюдались хроматидные разрывы,, эрозии хромосом вплоть до феномена пульверизации и крайней степени: фрагментации. Интересным феноменом, не наблюдавшимся другими авторами, было преждевременное разделение и отталкивание центромерных участков, в то время как сестринские хроматиды оставались еще сближенными и параллельными друг другу (рис. 89). Эти авторы отмечают, что изменения морфологии клеток наблюдались как в красном, так и в белом ростке, но не в предшественниках гранулоцитов. Интересной особенностью- этого вещества является также то обстоятельство, что эффект был сильнее выражен у больных с солидными опухолями, у которых костный мозг нормальный.
Необходимо отметить, хотя это имеет косвенное отношение к цитогенетическому эффекту, что препараты типа цитозинарабинозида, также как и другие цитостатические средства (6-меркаптопурин, метатрексат,, преднизолон, 5-фторурацил, винкристин), резко снижают митотический: индекс и препятствуют бласт-трансформации клеток под влиянием фитогемагглютинина. Это показано в работе Hersch и Oppenheim (1967), изучавших бласт-трансформацию и митотический индекс в культурах лейкоцитов крови больных, леченных этими препаратами. Из других антиметаболитов следует упомянуть противомалярийный препарат пириметамин (дараприм) — антагонист фолиевой кислоты, который, как показано в работе Bottura и Coutinho (1964), при дозе 100 мг в день, кроме панцитопении, вызывает хромосомные аберрации, которые можно наблюдать в 10% клеток костного мозга. Наблюдались перестройки хромосомного и хроматидного типов, и разрывы распределялись неслучайно.
Необычный эффект 6-азауридина при лечении острого миелолейкоза наблюдали Elves, Buttoo, Israels и Wilkinson (1963). Под их наблюдением, было 3 больных, которые в течение 52 дней лечились указанным препаратом. Кроме хромосомных перестроек, таких, как дицентрики и разрывы, эти авторы обнаружили большой процент анэуплоидных клеток, слипание» хромосом и превращение их в аморфные глобулярные тельца и лишь окраска, размеры и очертание, а также число их говорили о том, что эта хромосомы.
Полиплоидию и эндоредупликацию наблюдали в большом проценте клеток у больных, леченных N,N-бис-(бромпропионил)-пиперазином, Nasjleti, Walden и Spencer (1965). Перечисленными работами исчерпываются исследования повреждающего действия химических препаратов на хромосомы живых людей. Этих исследований, конечно, недостаточно для того чтобы сделать выводы о закономерностях мутационного процесса, протекающего в популяциях соматических клеток при воздействии лекарственных препаратов. Однако уже на основании этих работ можно считать дока-занным, что почти все цитостатические препараты, особенно ингибиторы синтеза ДНК, вызывают хромосомные аберрации в активно пролиферирующих клетках кроветворной ткани. Важным выводом также является, что клетки с аберрантными хромосомами быстро исчезают из крови по окончании воздействия препаратов. Однако это касается клеток со свежими разрывами и нестабильными перестройками, и еще не было опубликовано работ, посвященных выяснению вопроса о том, не сохраняются ли длительно клетки с делетированными или транслоцированными хромосомами в крови людей. Такие клетки могли бы дать начало клонам клеток с ненормальными хромосомами. Эта работа чрезвычайно трудоемка, так как пришлось бы исследовать много хромосомных наборов путем составления систематизированных кариотипов.
Нужно отметить, что работ, посвященных выяснению мутагенного эффекта химических, в частности лекарственных, веществ на клетки человека в культуре, гораздо больше. Однако большинство авторов не делает различий между перевиваемыми клетками человеческого происхождения и клетками первичной культуры человеческой ткани, хотя различия этих систем очевидны и общепризнаны. В исследованиях такого рода показан мутагенный эффект целого ряда алкилирующих соединений (Н. П. Дубинин и Е. Г. Сапрыкина, 1964; Hampel, Gerhartz, 1965; Hampel и др., 1966), аналогов оснований (Kaback и др., 1964, 1965), ингибиторов синтеза ДНК (Nichols, Heneen, 1965; Kihlman и др., 1963; Nichols, 1964), антибиотиков (Cohen, Shaw, 1964; Cohen и др., 1963; Ostertag, Kersten, 1965), акридинов (Ostertag, Kersten, 1965) и некоторых тератогенов, в частности талидомида (Krogh, 1965). В ходе этих исследований было показано, что разрывы, вызванные химическими веществами, распределяются среди хромосом разных групп и по длине хромосомы не случайно. Есть хромосомы, которые поражаются чаще, чем другие, и существуют участки в хромосомах, в которых разрывы локализуются чаще. Как правило, разрывы, индуцированные химическими агентами, локализуются в гетерохроматиновых районах. Удалось выяснить также, что спектр и частота аберраций различны в зависимости от класса примененных химических веществ. Так, например, алкилирующие соединения вызывают такие же перестройки, как ионизирующая радиация, в то время как ингибиторы синтеза ДНК обусловливают повреждения хромосом, чрезвычайно сходные с вызываемыми вирусами. Противораковые антибиотики, такие, как стрептонигрин, митомицин и др., очень часто вызывают своеобразные фигуры типа «крестов», которые исследователи считают проявлением соматического кроссинговера. Несмотря на то что исследований, выполненных на человеческом материале, еще чрезвычайно мало, совершенно ясно, что существует множество химических веществ, в том числе широко применяемых в клинике лекарственных препаратов, которые вызывают повреждения хромосом. Таким образом, можно считать доказанным, что одним из факторов хромосомных мутаций у человека являются вводимые извне химические вещества. Однако, чтобы оценить реальный вклад химических агентов в мутационный процесс, мало знания того, что они индуцируют, пусть даже в значительной части клеточной популяции, разнообразные хромосомные аберрации. Совершенно необходимо знание дальнейшей судьбы клеток, содержащих аберрантные хромосомы. Как уже говорилось, из наблюдений над больными, леченными цитостатическими агентами, следует, что клетки со свежими разрывами и нестабильными в митозе перестройками быстро исчезают из кроветворной ткани. Однако в экспериментах с вирусами в культуре диплоидных клеток человека (Wolman и др., 1964; Todaro, Green, 1965) показано, что после однократного воздействия вируса на клетки вслед за взрывом процессов разрывов и воссоединений, спустя несколько клеточных поколений, начинается клонообразование, причем клетки — родоначальницы клонов содержат самые разнообразные перестройки хромосом: делегированные хромосомы и новые, необычные для человеческого кариотипа хромосомы, возникшие в результате транслокаций. Подобных исследований с химическими веществами еще не проведено. Если существует относительная ясность в вопросе о мутационном процессе, индуцированном химическими агентами в соматических клетках, то этого нельзя сказать об индуцированных изменениях хромосом в мейозе. Один из первых вопросов, которые надлежит решить при исследовании этой проблемы, заключается в выяснении степени проницаемости в герминативную ткань химических препаратов и их дальнейшей судьбы в организме. Пока таких исследований мало. Goldstein (1962) указывает, что кофеин, введенный в дозе 500 мг внутривенно пациенту, спустя примерно 10 минут был обнаружен в крови тестикул в количестве 19 мг/л (операция по поводу опухоли предстательной железы с кастрацией). Мутагенность кофеина продемонстрирована на целом ряде объектов, в том числе на клетках человека в культуре (Ostertag и др., 1965). Motulsky (1962) при обсуждении обзора Goldstein сообщил, что он наблюдал наступление полной стерильности у мужчин и женщин, леченных алкилирующими агентами по поводу болезни Ходжкина. Эти данные указывают на возможность проникновения мутагенных веществ через гематогонадные барьеры. Наряду с этим имеется достаточное количество исследований, убедительно демонстрирующих проникновение мутагенных лекарственных препаратов через плацентарный барьер. В частности, Fabre и Regnier (1934) показали, что тот же кофеин легко проходит этот барьер.
В обзоре В. И. Бодяжиной (1964) собран большой материал относительно целого ряда лекарственных препаратов, проходящих через плацентарный барьер и действующих на развивающийся эмбрион. Интересно также упомянуть об исследованиях, выполненных в лаборатории, руководимой А. П. Дыбаном, В. С. Барановым, который показал, что антиметаболиты фолиевой кислоты вызывают уродства у зародышей крыс. Эти же препараты вызывают хромосомные аберрации и дефицит витамина В12, принимающего участие в метаболизме фолиевой кислоты, вызывает множественные хромосомные аберрации в клетках костного мозга у больных В12-дефицитной анемией.
Нельзя не упомянуть о целом ряде работ, в которых сообщается о мутагенном действии лекарственных препаратов и пищевых компонентов на различные тест-объекты. Кроме уже цитировавшегося обзора Barthelmess, следует указать на обзор Goldstein (1962), в котором на основании химического строения многие вещества, широко используемые в медицине, заподозриваются в мутагенных свойствах. К ним относятся все цитостатические средства со свойствами алкилирующих соединений: кофеин, теофилин и теобромин; противомикробные антиметаболиты; природные фенолы типа адреналина; стероидные гормоны; антисептики типа метенамина; наркотические средства паральдегид и хлоралгидрат, атропин, никотин и целый ряд других агентов. Мутагенность некоторых из них показана на дрозофиле и бактериях. Повреждающее действие пенициллина на хромосомы показано на луке (Levan, Tjio, 1951). На этом же объекте продемонстрировано повреждающее действие на хромосомы целого ряда рентгено-контрастных веществ (Bauchinger, 1964). Большое количество такого рода исследований обобщено в обстоятельном обзоре Rohrborn (1965). Мутагенность для дрозофилы целого ряда химиотерапевтических препаратов, в том числе некоторых средств, действующих на нервную систему, продемонстрирована в нескольких работах И. А. Рапопорта (И. А. Рапопорт, 1963; И. А. Рапопорт, 1966; И. А. Рапопорт и Л. М. Филипова, 1965).
Изучение мутагенного действия химиотерапевтических препаратов и промышленных токсинов имеет тенденцию формироваться в специальную дисциплину — токсикогенетику (И. А. Рапопорт, 1966). Однако необходимо отметить, что указанные исследования не столько доказывают мутагенность того или иного препарата для человека, сколько сигнализируют о необходимости изучения этого на человеке, сигнализируют о потенциальной опасности. Во всяком случае, исследователь, желающий выяснить мутагенность какого-либо препарата для человека, стоит перед сложным выбором.
Можно исследовать клетки, полученные непосредственно от индивидуума, подвергшегося действию определенного препарата; при этом ограничивается ассортимент подлежащих исследованию веществ и приходится мириться с невозможностью заглянуть в «черный ящик» организма, где происходят процессы превращения веществ, вводимых извне, и трудно непосредственно исследовать динамику клеточных популяций. Можно упростить исследование, ограничившись системой «клетка — питательная среда — вещество». Эта система позволяет вынести за скобки многие процессы, усложняющие исследование, но вносят другое осложнение — необходимость экстраполяции с условий культуры клеток на условия организма. Существует третья возможность применить тонкие и точные методы учета мутаций при использовании дрозофилы и других лабораторных объектов. За эту точность приходится расплачиваться еще более отдаленными экстраполяциями и пренебрежением явно существующей видовой спецификой в отношении химических мутагенов. Однако, несмотря на эти сложности, комплексное использование перечисленных методов, дополняющих друг друга, может дать достаточную информацию о мутагенном действии химических препаратов, попадающих в организм человека.